ชนิดของพันธะเคมี
พันธะภายในโมเลกุล
(intramolecular bond)
|
พันธะระหว่างโมเลกุล
(intermolecular bond) |
พันธะโคเวเลนต์ (covalent bonds)
|
พันธะไฮโดรเจน (hydrogen bonds)
|
พันธะไอออนิก (ionic bonds)
|
แรงแวนเดอร์วาลส์ (Van der Waals forces)
|
พันธะโลหะ ( metallic bonds)
|
แรงดึงดูดระหว่างโมเลกุล - ไอออน
(molecule-ion attractions) |
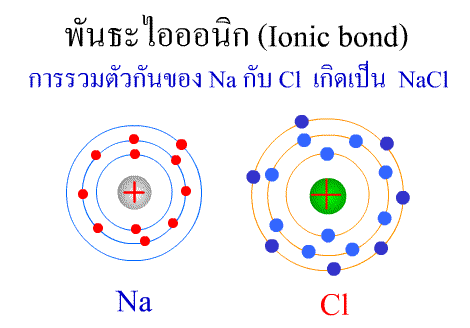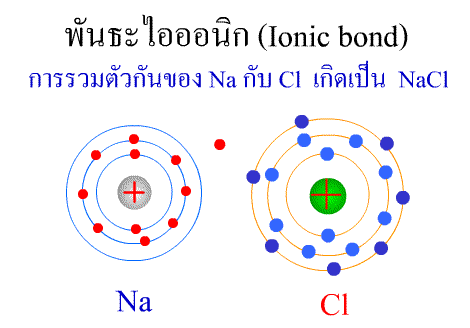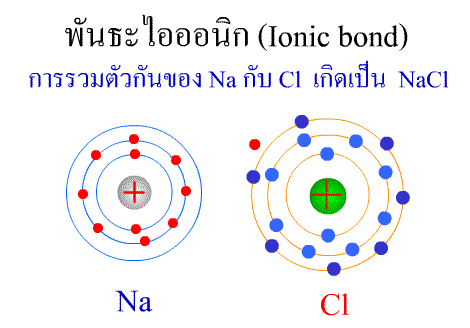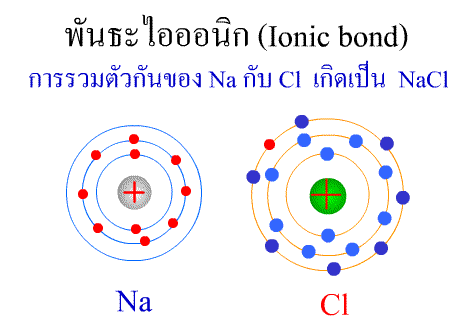
พันธะไอออนิก
พันธะไอออนิก ( Ionic bond ) หมายถึงแรงยึดเหนี่ยวที่เกิดในสารประกอบที่เกิดขึ้นระหว่าง 2 อะตอมอะตอมที่มีค่าอิเล็กโตรเนกาติวิตีต่างกันมาก อะตอมที่มีค่าอิเลคโตรเนกาติวิตีน้อยจะให้อิเลคตรอนแก่อะตอมที่มีค่าอิเลคโตรเนกาติวิตีมาก และทำให้อิเล็กตรอนที่อยู่รอบๆ อะตอมครบ 8 (octat rule ) กลายเป็นไอออนบวก และไอออนลบตามลำดับ เกิดแรงดึงดูดทางไฟฟ้าระหว่างไอออนบวกและไอออนลบ และเกิดเป็นโมเลกุลขึ้น เช่น การเกิดสารประกอบ NaCl ดังภาพ
พันธะโควาเลนต์
พันธะโควาเลนต์ (Covalent bond) หมายถึง พันธะในสารประกอบที่เกิดขึ้นระหว่างอะตอม 2 อะตอมที่มีค่าอิเล็กโตรเนกาติวิตีใกล้เคียงกันหรือเท่ากัน แต่ละอะตอมต่างมีความสามารถที่จะดึงอิเล็กตรอนไว้กับตัว อิเล็กตรอนคู่ร่วมพันธะจึงไม่ได้อยู่ ณ อะตอมใดอะตอมหนึ่งแล้วเกิดเป็นประจุเหมือนพันธะไอออนิก หากแต่เหมือนการใช้อิเล็กตรอนร่วมกันระหว่างอะตอมคู่ร่วมพันธะนั้นๆและมีจำนวนอิเล็กตรอนอยู่รอบๆ แต่ละอะตอมเป็นไปตามกฎออกเตต ดังภาพ

พันธะโลหะ
พันธะโลหะ (Metallic Bond ) คือ แรงดึงดูดระหว่างไออนบวกซึ่งเรียงชิดกันกับอิเล็กตรอนที่อยู่โดยรอบหรือเป็นแรงยึดเหนี่ยวที่เกิดจากอะตอมในก้อนโลหะใช้เวเลนส์อิเล็กตรอนทั้งหมดร่วมกัน อิเล็กตรอนอิสระเกิดขึ้นได้ เพราะโลหะมีวาเลนส์อิเล็กตรอนน้อยและมีพลังงานไอออไนเซชันต่ำ จึงทำให้เกิดกลุ่มของอิเล็กตรอนและไอออนบวกได้ง่าย